LAPORAN PRAKTIKUM FARMASI FISIKA II
“KOEFISIEN
PARTISI”
Oleh
NAMA / NIM : Rinto Aditya / D1A141029
PARTNER
1.
NAMA/NIM : Icha Febrilia Utami / D1A140883
2.
NAMA/NIM : Noviya Nur Asyifah / D1A140915
3.
NAMA/NIM : Sri Rosmianti / D1A140916
LABORATORIUM
FISIKA JURUSAN FARMASI
FAKULTAS
MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS
AL-GHIFARI
BANDUNG
2015
BAB
I
PRINSIP
DAN TUJUAN
1.1 Tujuan
Mengetahui PH terhadap koefisien partisi
yang bersifat asam lemah dalam campuran pelarut kloroform air.
1.2 Prinsip
Penentuan koefisien distribusi/koefisien
partisi dari asam borat dan asam benzoat berdasarkan pada perbandingan
kelarutan suatu zat dalam dua pelarut yang tidak saling bercampur yakni dalam
minyak dan air.
BAB II
TEORI
2.1 Teori
Dasar
Koefisien
partisi lipida air suatu obat adalah perbandingan kadar obat dalam fase lipoid
dan fase air setelah mencapai kesetimbangan. Peranan koefisien partisi
obat-obat dalam bidang farmasi sangat penting. Teori-teori tentang absorbsi,
ekstraksi, dan kromatografi banyak terkait dengan teori koefisien partisi.
Kecepatan absorbsi obat sangat dipengaruhi oleh koefisien partisinya. Hal ini
disebabkan oleh komponen dinding usus yang sebagian besar terdiri dari lipida
akan sangat sukar dilakukan absorbsi. Obat-obat yang mudah larut dalam lipida
tersebut dengan sendirinya memiliki koefisien partisi lipida-air yang besar,
sebaliknya obat-obat yang sukar larut dalam lipida akan memiliki koefisien
partisi yang kecil.
Pada
umumnya obat-obat bersifat asam lemah atau basa lemah. Jika obat-obat tersebut
dilarutkan dalam air, sebagian akan terionisasi. Besarnya fraksi obat yang
terionkan tergantung pH larutannya. Obat-obat yang tidak terionkan (unionized)
lebih mudah larut dalam lipida, sebaliknya yang dalam bentuk ion kelarutannya
kecil atau bahkan praktis tidak larut, dengan demikian pengaruh pH terhadap
kecepatan absorbsi obat-obat yang bersifat asam lemah atau basa lemah sangat
besar. Untuk menghitung fraksi obat-obat yang tidak terionkan dapat digunakan
persamaan Henderson – Hasselbach, yaitu :
o
Untuk
asam lemah
o
Untuk basa lemah
Ada
dua macam koefisien partisi:
a. Koefisien partisi sejati atau TPC (True
Partition Coefficient)
Untuk koefisien partisi ini pada percobaan harus memenuhi syarat
kondisi sebagai berikut:
o
Antara
kedua pelarut benar-benar tidak dapat campur satu sama lain.
o
Bahan
obatnya (solute) tidak mengalami asosiasi atau disosiasi.
o
Kadar
obatnya relatif kecil (<0,01 M).
o
Kelarutan
solute pada masing-masing pelarut kecil.
Jika semua persyaratan tersebut dipenuhi, maka
berlaku persamaan :
Dengan :
C1 = kadar obat dalam
fase lipoid
C2
= kadar obat dalam ase air
b. Koefisien partisi semu atau APC (Apparent
Partition Coefficient)
Apabila persyaratan TPC tidak dapat dipenuhi,
maka hasilnya adalah koefisien partisi semu. Dalam biofarmasetika dan pada
berbagai tujuan yang lain, umumnya memiliki kondisi non ideal
dan tidak disertai koreksinya, sehingga
hasilnya adalah koefisien partisi semu. Biasanya sebagai fase lipoid adalah
oktanol, kloroform, sikloheksan, isopropil miristat, dan lain-lain. Fase air
yang biasanya digunakan adalah larutan dapar. Pada keadaan ini berlaku
persamaan:
Dengan :
C20 = Kadar obat salam fase air mula-mula.
C2’ = Kadar obat dalam fase air setelah mencapai
kesetimbangan.
a = Volume fase air.
b = Volume fase lipoid.
(Anonim, 2012)
Adanya
pemahaman tentang koefisien partisi dan pengaruh pH pada koefisien partisi akan
bermanfaat dalam hubungannya dengan ekstraksi dan kromatografi obat. Secara
sederhana koefisien partisi suatu senyawa (P) dapat ditentukan dengan :
Dengan :
Co = Konsentrasi senyawa pada fase organik.
Cw = Konsentrasi senyawa dalam air.
Semakin
besar nilai P maka semakin banyak senyawa dalam pelarut organik. Nilai P suatu
senyawa tergantung pada pelarut organik tertentu yang digunakan untuk melakukan
pengukuran. Beberapa pengukuran koefisien partisi dilakukan dengan menggunakan
partisi air dan n-oktanol. (Ghalib, 2007)
Hukum
distribusi atau partisi. Cukup diketahui bahwa zat-zat tertentu lebih mudah
larut dalam pelarut-pelarut tertentu dibanding dengan pelarut-pelarut yang
lain. Jadi iod jauh lebih dapat larut dalam karbon disulfida, kloroform, atau
karbon tetraklorida daripada dalam air. Lagi pula, bila cairan-cairan tertentu
seperti karbon disulfida dan air, dan juga eter dan air, dikocok bersama-sama
dalam suatu bejana dan campuran kemudian dibiarkan, maka kedua cairan akan
memisah menjadi dua lapisan. Cairan semacam itu dikatakan sebagai tak dapat
campur (karbon disulfida dan air) atau setengah campur (eter dan air),
bergantung pada apakah satu kedalam yang lain hampir tak dapat larut atau
setengah dapat larut.
Jika iod
dikocok bersama suatu campuran karbon disulfida dan air serta kemudian
didiamkan, iod akan dijumpai terbagi dalam kedua pelarut itu. Suatu keadaan
kesetimbangan terjadi antara larutan iod dalam karbon disulfida dan larutan iod
dalam air. Ternyata bila banyaknya iod diubah-ubah. (Vogel, 1985)
BAB III
PROSEDUR PERCOBAAN
3.1 Alat dan Bahan
a. Alat
o
Tabung reaksi
o
Pipet
o
Pengukur PH
o
Inkubator
o
Batang pengaduk
o
Gelas kimia
b. Bahan
o
Asam salisilat
o
Natrium hidroksida
o
Kloroform p.a
3.2 Cara Kerja
a. Tahap 1
b. Tahap 2
c. Tahap
3
Tentukan kadar
salisilat dalam fase air dan kloroform pada menit ke 0; 15; 30; 45; dan 60.
d. Tahap
4
Buat kurva hubungan
antara as.Benzoat dan air dengan kloroform.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
atau data pengamatan
a. Fase
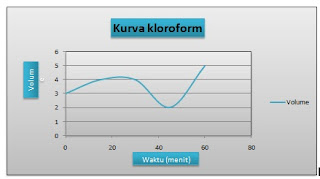
kloroform
|
Kloroform
|
|||
|
t (waktu)
|
V. awal
|
V. akhir
|
V, terpakai
|
|
0
menit
|
0 Ml
|
3 mL
|
3 mL
|
|
15
menit
|
4 mL
|
8 mL
|
4 mL
|
|
30
menit
|
15 mL
|
19 mL
|
4 mL
|
|
45
menit
|
19 mL
|
21 mL
|
2 mL
|
|
60
menit
|
23 mL
|
28 mL
|
5 mL
|
|
Volume rata-rata
|
3.6 mL
|
||
b. Fase
air
|
Air yang mengandung asam benzoate
|
|||
|
t (waktu)
|
V. awal
|
V. akhir
|
V, terpakai
|
|
0
menit
|
3
mL
|
4
mL
|
1
mL
|
|
15
menit
|
8
mL
|
12
mL
|
4
mL
|
|
30
menit
|
12
mL
|
15
mL
|
3
mL
|
|
45
menit
|
21
mL
|
23
mL
|
2
mL
|
|
60
menit
|
28
mL
|
30
mL
|
2
mL
|
|
Volume
rata-rata
|
2.4
mL
|
||
4.2 Pembahasan
Praktikum ini bertujuan untuk mengetahui
pengaruh pH terhadap koefisien partisi obat yang bersifat asam lemah dalam
campuran pelarut kloroform-air. Pengertian koefisien partisi lipida air suatu
obat adalah perbandingan kadar obat dalam fase lipoid dan fase air setelah
tercapai kesetimbangan. Dalam bidang farmasi, peranan koefisien partisi
obat-obat juga sangat penting.
Toeri-teori tenteng absorbsi, ekstraksi, dan kromatografi juga banyak terkait
dengan teori koefisien partisi (Anonim, 2012).
Pada percobaan ini digunakan fase air
berupa larutan dapar asam salisilat, dan yang berfungsi sebagai fase lipoidnya
adalah kloroform. Koefisien partisi sangat mempengaruhi kecepatan absorbsi
obat. Hal ini disebabkan karena kemampuan dinding usus yang sebagian besar
terdiri dari lipid akan sangat sukar dilakukan absorbsi. Semakin besar
koefisien suatu obat, maka semakin cepat pula obat tersebut terabsorbsi, atau
dapat pula dikatakan jika obat mudah larut dalam lipid berarti koefisien
partisi lipid-airnya besar.
Untuk obat-obat yang bersifat asam lemah
atau basa lemah, jika dilarutkan dalam air maka separuh dari itu akan
terionisasi. Banyaknya fraksi obat yang
terion tergantung pada pH larutannya. Untuk obat asam lemah apabila pH
makin besar, maka fase yang terionisasi juga makin banyak. Pada pH yang tinggi,
obat akan mengalami peristiwa penggaraman dimana garam tersebut oleh air akan
terurai menjadi bentuk-bentuk ionnya. Hal tersebut dapat terjadi pada asam salisilat,
karena asam salisilat termasuk asam lemah. Maka jika pH semakin tinggi, asam
salisilat akan terionkan, dan dalam fase lipoid akan tidak larut, tetapi pada
fase air akan larut (menunjukkan bahwa pada pH yang tinggi, kadar asam
salisilat dalam air tinggi dan dalam fase lipoid rendah).
Dalam praktikum ini digunakan larutan
dapar asam salisilat dengan pH yang berbeda-beda yaitu 5, masing-masing tabung
sebanyak 5 ml dan dimasukkan ke dalam 5 tabung. Digunakan larutan dapar
bertujuan agar dapat mempertahankan harga pH larutan.
Selanjutnya, pada tiap tabung yang sudah
terisi larutan dapar, ditambahkan 10 ml kloroform. Lalu akan terjadi dua
lapisan atau dua fase zat cair yang tidak bercampur. Lapisan kloroform berada
dibagian bawah, karena berat jenisnya lebih besar dibandingkan dengan berat
jenis air pada larutan dapar. Selain itu karena adanya perbedaan sifat dari
kedua fase tersebut dimana kloroform
bersifat non polar sedangkan dapar salisilat bersifat polar sesuai teori
”like dissolve like” yaitu larutan yang bersifat sama akan saling bercampur
atau saling melarutkan.
Selanjutnya kelima tabung tersebut diinkubasi
selama 60 menit pada suhu 37  menggunakan alat inkubator. Tujuan
dilakukannya inkubasi adalah agar larutan menjadi setimbang, dimana dalam suatu
reaksi kimia kecepatan reaksi ke kanan sama dengan kecepatan reaksi ke kiri.
Dapat dikatakan pula jika pada temperatur, tekanan dan konsentrasi tertentu
maka reaksi tersebut energinya sama antara produk dan reaktan, sehingga
hubungan konsentrasi dan hasil reaksi tetap. Sedangkan suhu yang digunakan 37
menggunakan alat inkubator. Tujuan
dilakukannya inkubasi adalah agar larutan menjadi setimbang, dimana dalam suatu
reaksi kimia kecepatan reaksi ke kanan sama dengan kecepatan reaksi ke kiri.
Dapat dikatakan pula jika pada temperatur, tekanan dan konsentrasi tertentu
maka reaksi tersebut energinya sama antara produk dan reaktan, sehingga
hubungan konsentrasi dan hasil reaksi tetap. Sedangkan suhu yang digunakan 37 adalah untuk menyesuaikan keadaan agar sesuai
dengan suhu tubuh, karena setelah obat diminum akan mengalami fase farmasetik,
farmakokinetik (ADME) dan fase farmakodinamik. Penggunaan kloroform sebagai fase
lipoid karena kloroform memiliki sifat yang mirip dengan lipid yang ada dalam
tubuh.
adalah untuk menyesuaikan keadaan agar sesuai
dengan suhu tubuh, karena setelah obat diminum akan mengalami fase farmasetik,
farmakokinetik (ADME) dan fase farmakodinamik. Penggunaan kloroform sebagai fase
lipoid karena kloroform memiliki sifat yang mirip dengan lipid yang ada dalam
tubuh.
Selanjutnya dilakukan titrasi dengan 10
mL NaOH 0,01 M + 90 mL air, yang pada kedua larutan baik pada air yang
mengandung asam benzoate atau kloroform keduanya di tambahkan 3 tetes
fenolftalein sebagai indikatornya. Pada air yang mengandung asam benzoate
didapatkan volume rata-ratanya yaitu 2,4 mL sedangkan untuk kloroform didapat
volume rata-ratanya yaitu 3,6 mL.
BAB V
KESIMPULAN
Ø Larutan
dapar salisilat berperan sebagai fase air.
Ø Kloroform
berperan sebagai fase lipoid.
Ø Untuk
titrasi air yang mengandung asam benzoate, waktu penyaringan fase tidak
mempengaruhi volume titrasi.
Ø Untuk
titrasi kloroform, waktu penyaringan fase mempengaruhi volume titrasi, semakin
lama waktu penyaringan maka semakin banyak pula volume titrasi yang terpakai.
LAMPIRAN
a. Kurva
Ø Air
yang mengandung asam benzoate
Ø Kloroform
b. Gambar
(hasil titrasi)
DAFTAR PUSTAKA
Anonim. 2012. Kumpulan Modul Praktikum Kimia Fisika. Surakarta : UMS.
Gandjar, Ibnu Ghalib, dkk. 2007. Kimia Farmasi Analisis. Yogyakarta :
Pustaka Pelajar.
Vogel. 1985. Buku Teks Analisis Anorganik Kualitatif Makro dan
Semimikro. Jakarta : PT. Kalman Media Pustaka.





Tidak ada komentar:
Posting Komentar